Биологическое обоснование трансплантации в пазуху верхней челюсти
Georg Watzek, MD, DMD, PhD
Gabor Furst, MD, DDS
Reinhard Gruber, PhD
Выживаемость имплантатов в аугментированных
участках
пазухи
Объём пазухи верхней челюсти увеличивается с возрастом и потерей
зубов и колеблется от 4,5 до 35,2 см3. Потеря кости верхней челюсти сопровождается
увеличением
пазухи и наблюдается в большей степени по горизонтали, чем по вертикали. По
классификации Cawood и Howell, атрофия альвеоляного отростка разделена на
степени от 1-й (при наличии зубов) до 6-й (толщиной с бумагу) (1).
При степени атрофии от 4-й до 6-й вертикальный объём кости является основным
фактором,
ограничивающим
установку имплантатов (2).
Трансплантация в пазуху верхней челюсти увеличивает высоту
её заднего отдела перед установкой имплантатов. В 1996 году Согласительная
конференция по верхнечелюстной пазухе объявила методику синуслифтинга предсказуемой
и эффективной
лечебной манипуляцией (3).
Выживаемость имплантатов, установленных в аугментированные
пазухи и находящихся под функциональной нагрузкой, варьировала
от 36% (4) до 61,7% (5), достигая даже 100% в недавних мета-анализах.
Общая
степень успеха составляет 91,6% для имплантатов с шероховатой
поверхностью и 92,3% при использовании отдельных костных трансплантационных
материалов (5). Оба этих фактора вместе с применением методик направленной
костной регенерации были признаны позитивными для долговременной стабильности
функционирующих имплантатов (5).
Влияют ли другие факторы (возраст, системные заболевания,
факторы образа жизни, одно- или двух - стадийные процедуры, вертикальный размер
оставшейся кости)
на выживаемость имплантатов при аугментации пазух не было точно определено
(4, 5). Более того, в эти мета-анализы не были включены неудачные
трансплантации в пазуху, случаи, когда первоначальная стабильность имплантатов
не была достигнута или
имплантаты были
потеряны на ранних стадиях оссеоинтеграции.
Сообщалось, что неудачи до начала протезирования происходили
у 3,6% пациентов, когда имплантаты устанавливали в кость без трансплантации.
Все эти наблюдения могут
существенно снизить общую степень успеха процедуры трансплантации в пазуху.
Оссеоинтеграция, является необходимым условием для долговременной
стабильности дентальных имплантатов при их функциональной нагрузке и зависит
от динамического
процесса регенерации кости, как это изначально было определено Branemark и
др. (7), и в дальнейшем переработано Schenk и Buser (8).
Костная интеграция инициируется формированием сгустка крови
вокруг имплантата, который замещается сначала грануляционной тканью, затем
губчатой костью и,
наконец, пластинчатой костью (9, 10). Следовательно, дентальные
имплантаты должны устанавливаться в живую кость, которая имеет кровоснабжение,
остеогенные
клетки, факторы роста и дифференциации и предварительный внеклеточный матрикс
(11, 12). Первичная стабильность должна быть достигнута для
внутримембранного формирования кости вокруг дентальных имплантатов (7,
13).
Однако достижение
первичной стабильности не является очень простым делом.
Сообщалось о 32% ранних неудач при установке имплантатов с
неадекватной первичной стабильностью (14, 15). 4-ый тип кости,
который характеризуется тонким кортикальным слоем и рыхлыми трабекулами, не
обладает свойствами, которые позволяют имплантатам
достигать первичной стабильности с высокой степенью успеха (16).
Область моляров верхней челюсти имеет объём трабекулярной кости 17% у женщин
и 23% у мужчин,
с широкими вариациями в каждой группе (17). 4-ый тип кости
преобладает в области моляров при адентии верхней челюсти (68%
у женщин и 62% у мужчин) (17). Первичная
стабильность может быть несколько увеличена при помощи конденсации кости,
модификации дизайна и поверхности имплантата. К сожалению, эти методы имеют
ограниченный потенциал при большой резорбции заднего отдела верхней челюсти,
структурная целостность которой недостаточна (см. главу 27).
Динамический процесс консолидации трансплантата
Цель трансплантации в пазуху верхней челюсти реконструировать
её задний резорбированный отдел, чтобы дать возможность стабильно
установить дентальные
имплантаты. Эта стабильность достигается при помощи оссеоинтеграции, которая
является динамическим процессом .
Консолидация (соединение) материала трансплантата с костью
хозяина является необходимым условием для оссеоинтеграции. Консолидированный
трансплантат
окружён
и окутан
вновь созданной костью и за счёт процесса функционального ремоделирования инкорпорирован
в васкулярное ложе живого хозяина.
Консолидация подразумевает формирование единого комплекса трансплантата и
губчатой кости. Этот субстанция ремоделируется в пластинчатую кость и в дальнейшем
адаптирует основные функциональные нагрузки.
Консолидация трансплантата требует обильного кровоснабжения
и наличия остеогенных клеток, которые образуют новую кость на плотной поверхности
(19). Необходимым является продолжение
доставки остеогенных клеток, так как остеобласты заканчивают
свой жизненный цикл в качестве остеоцитов и линейных клеток или подвергаются
апоптозу (естественная смерть клетки, часть нормального процесса роста;
по течению и последствиям радикально отличается от смерти от внешних либо других
воздействий) (20). Следовательно, структура кровоснабжения,
функция остеобластов и консолидация трансплантата функционально взаимосвязаны.
Густая васкулярная сеть верхней челюсти уменьшается после потери зубов и в
процессе старения организма. Так как от 70% до 100% кровеносных сосудов верхней
челюсти берут начало из периоста (21), необходимо уделять большое внимание
обеспечению атравматичного поднятия слизистой оболочки. Разрыв слизистой оболочки
синуса, помимо прочего, снижает местное кровенаполнение, что может осложнить
консолидацию трансплантата и выживаемость имплантатов (22).
В зависимости от технологической обработки материала трансплантата, на ранних
стадиях инкорпорации костного трансплантата кровеносные сосуды пускают ростки
внутрь гаверсовых каналов трансплантированных блоков или в пространства между
частицами размельчённых костных материалов. Кровеносные сосуды организуются
ангиогенными сигнальными молекулами, выделяемыми в область дефекта активированными
тромбоцитами (23), мигрирующими макрофагами и остеогенными клетками (25).
Состояние
гипоксии на ранних стадиях в области участка трансплантата обеспечивает дальнейший
стимул для выделения ангиогенных молекул макрофагами (26) и остеогенными
клетками (27). Сгусток крови служит в качестве резервуара ангиогенных факторов,
таких
как васкулярный эндотелиальный фактор роста и основной фибробластный фактор
роста (28). Почкование капилляров внутрь участков дефекта является изобильным,
обычно превосходящим структуру вновь сформированной кости. Исследования in
vitro наводят на мысль, что эндотелиальные клетки обеспечивают стимул для
привлечения остеогенных клеток внутрь грануляционной ткани в области дефекта
(бокс 2-1)
(29).
БОКС 2-1 Регуляция остеогенной дифференцировки и формирования кровеносных
сосудов
После поднятия пазухи разрыв кровеносных сосудов приводит к немедленному формированию
сгустка крови, который окутывает трансплантат и создаёт временный внеклеточный
богатый фибрином матрикс.
Аккумулирование тромбоцитов, а позднее нейтрофилов и макрофагов,
служит источником факторов роста, включающих PDGF, VEGF, bFGF, а также широкий
спектр других
биоактивных молекул (30).
PDGF является мощным митогеном и хемоаттрактантом для остеогенных клеток,
но может временно сдерживать их дифференциацию (31-33). PDGF индуцирует формирование
кровеносных сосудов и действует сообща с VEGF и bFGF в данном процессе (34,
35). Фосфолипид сфингозин-1-фосфат, который выделяется из активированных тромбоцитов,
имеет мощную ангиогенную активность (36). Ангиогенез (образование новых капилляров
из существующих кровеносных сосудов) является многоступенчатым процессом, инициируемым
разрушением базальной мембраны протеазами, такими как матричные мталлопротеиназы.
После того как эндотелиальные клетки освобождены, они мигрируют внутрь интерстициальной
стромы, где они пролиферируют и формируют подобные капиллярам структуры, прежде
чем они продуцируют базальную мембрану и привлекают перициты (37, 38).
Параллельно эндотелиальные клетки-предшественники, которые
происходят из костного мозга, переносятся с помощью кровотока в область формирования
кровеносных сосудов,
где они способствуют прорастанию капилляров – процессу, названному васкулогенез
(39).
Как только сгусток крови замещён богатой
кровеносными сосудами грануляционной тканью, инициируется дифференцировка
мезенхимальных клеток-предшественников
в функциональные остеобласты, так же как это наблюдается в области удалённых
зубов (40) и в процессе оссеоинтеграции дентальных имплантатов
(9). Хотя механизмы,
которые регулируют остеогенную дифференциацию в этот конкретный период времени,
не известны в деталях, они, вероятно, должны включать в себя реакцию на факторы
дифференциации. К этим факторам относят такие вещества, как структуры семейства
ВМР (41),
протеины Хедчхога (Hedgehog) и факторы, влияющие на бескрылый тип передачи
сигнала (wingless-type
signaling
(Wnt)) (42, 43). Активация этих сигнальных проводящих путей
может корректировать выделение факторов транскрипции, таких как RUNX-2 и Osterix,
которые управляют
процессом дифференцировки (44). Хондрогенная дифференцировка
мезенхимальных клеток-предшественников в области трансплантата, вероятно, будет
инициирована механически
нестабильными состояниями, которые мешают формированию кровеносных сосудов
(45). Более того, остеобласты обеспечивают нишу для кроветворных
стволовых клеток, наводя на мысль, что они вовлечены в формирование костного
мозга в
аугментированной области (рисунок 2-1) (46).
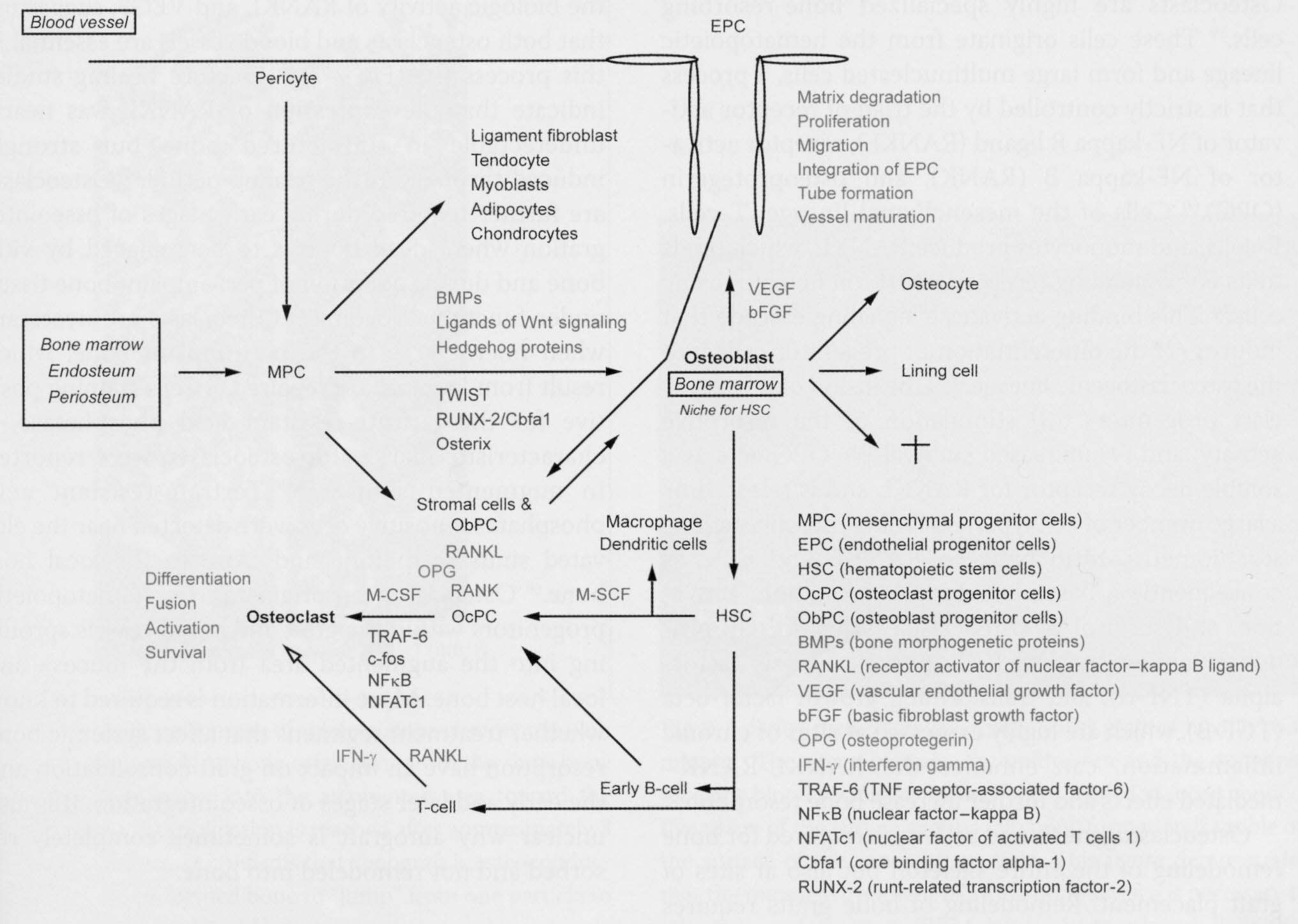
Рисунок 2-1 Последовательность и функциональная взаимосвязь
формирования кровеносного сосуда, остеогенной дифференцировки и остеокластогенеза,
как это описано
в боксах 2-1 и 2-2. Кровеносные сосуды обеспечивают источник циркулирующих
кроветворных клеток-предшественников и васкулярных перицитов, которые являются
предшественниками остеокластов и остеобластов соответственно. Открытия последнего
времени наводят
на мысль, что остеогенные клетки транспортируются посредством кровотока (47).
Не зависимо от происхождения мезенхимальные клетки-предшественники требуют
аутокринных (аутокринный - стимулирующий себя (клетка секретирует
регуляторный фактор и рецепторы к нему)) и паракринных (паракринный
эффект – выделение эндокринными клетками локально действующих субстанций)
сигналов, которые регулируют их миграцию, пролиферацию и дифференцировку
в костеобразующие остеобласты.
Менее дифференцированный фенотип остеогенного ряда поддерживает процесс остеокластогенеза,
поставляя M-CSF и ключевой фактор RANKL. При физиологических состояниях остеокластогенез
регулируется балансом между концентрацией рецептора-ловушки OPG и RANKL.
В участках хронического воспаления, происходящий из Т-клеток, IFN-гамма прямо
противодействует остеокластогенетическим эффектам RANKL и TNF-альфа, и на
ранних стадиях развития В-клетки могут служить в качестве клеток-предшественников
остеокластов. Предстоит выяснить имеет ли место этот остеоиммунологический
сценарий в процессе консолидации трансплантата. Остеобласты могут создать
благоприятное микроокружение для гемопоэтических стволовых клеток, остеогенные
клетки могут взаимодействовать с эндотелиальными клетками, и наоборот остеокласты
могут стимулировать образование кости. Становится понятным, что все эти явления
сильно взаимосвязаны и, что они важны в гармоничной оркестровке процесса
консолидации трансплантата.
Термины и сокращения рисунка2-1:
Blood vessel – кровеносный
сосуд
EPC – эндотелиальные клетки предшественники
Tube formation – формирование трубки
Vessel maturation – созревание сосуда
Bone marrow – костный мозг
MPC – мезенхимальные клетки-предшественники
BMPs – костные морфогенетические протеины
VEGF – васкулярный эндотелиальный фактор роста
Ligands of Wnt signaling – лиганды (лиганд – в химическом комплексном соединении
молекула или ион непосредственно связанные координационными связями с центральным
атомом/ионом (комплексообразователем) металла) бескрылого типа передачи сигнала
(wingless-type signaling (Wnt))
bFGF – основной фибробластный фактор роста
RUNX-2 – связанный с карликовым (runt-related) фактор транскрипции-2
Niche for HSC – ниша для гемопоэтических стволовых клеток
Lining cells – линейные/выстилающие клетки
ObPC – клетки-предшественники остеобластов
RANKL – рецепторный активатор ядерного фактора – каппа B лиганд
OPG – остеопротегерин
Dendritic cells – древовидные/ветвящиеся клетки
Fusion – слияние/синтез
OcPC- клетки предшественники остеокластов
HSC – гемопоэтические стволовые клетки
Survival – выживание
TRAF-6 – TNF рецепторный ассоциированный фактор-6
NFkB – ядерный фактор - каппа B
NFATc1 – ядерный фактор активированных Т клеток 1
IFN-гамма – гамма интерферон
БОКС 2-2 Регулирование дифференцировки остеокластов
Остеокласты являются высоко специализированными клетками,
резорбирующими кость (59). Эти клетки происходят из гемопоэтической
линии и принимают форму больших мультиядерных клеток. Этот процесс строго контролируется
триадой из рецепторного
активатора NF-каппа B лиганда (RANKL), рецепторного активатора NF-каппа B (RANK)
и остеопротегерина (OPG) (60). Клетки мезенхимальной линии,
T-клетки, B-клетки и моноциты продуцируют RANKL, который связывается с соответствующим
ему рецептором
RANK на гемопоэтических клетках (61). Это связывание активирует
сигнальный каскад, который индуцирует:
- Дифференцировку
клеток-предшественников в остеокластогенетическую линию,
- Синтез предшественников
остеокластов,
- Резорптивную активность
и
- Повышенную выживаемость (62, 63).
OPG выступает как растворимая
ловушка-рецептор для RANKL и выделяется большим количеством типов клеток,
включая остеобласты.
Стехиометрическое (стехиометрия (от греческого
stoicheion – первоначало, элемент и …метрия)
- учение о количественных соотношениях между массами веществ,
вступающих в химическую реакцию. Включает правила составления химических
формул и уравнений. Основывается на законах Авогадро, Гей-Люссака
и кратных отношений,
сохранения массы, эквивалентов. Цитировано по изданию
Советский энциклопедический словарь 1980 год, стр. 1284) соотношение
между RANKL и OPG является, следовательно, фактором формирования,
активации
и выживания остеокластов.
Другие местные
продуцируемый факторы такие как IL-1, опухолевый некротический фактор-альфа
(TNF-альфа) и трансформирующий
рост фактор-бетта (TGF-бетта), которые сильно выражены в участках
хронического воспаления, могут усиливать посреднический эффект RANKL-
RANK и
далее увеличивать
костную резорбцию (64).
Остеокластогенез и жизнедеятельность
этих клеток необходимы для костного ремоделирования всего скелета, а так
же для ремоделирования кости
в области установки трансплантата. Ремоделирование
костных трансплантатов требует биологической активности RANKL и VEGF, наводя
на мысль, что и остеокласты, и кровеносные сосуды необходимы для данного процесса
(см. рисунок 2-7) (65). Исследования заживления при переломах
показывают, что выделение RANKL почти не определялось в неповреждённых костях,
но было сильно
индуцировано на протяжении всего периода заживления (66).
Остеокласты в дальнейшем требуются в течение ранних стадий оссеоинтеграции,
когда мёртвая кость должна
быть замещена живой костью и во время периода адаптации кости вокруг имплантата
при функциональной нагрузке (11). Остеокласты необходимы,
когда восстанавливаются микротрещины кости вокруг имплантата. Эти трещины являются
результатом нагрузки
(67). Клетки, окрашивающиеся позитивно на наличие кислой фосфатазы
устойчивой/резистентной к тартрату (характерный маркер для остеокластов) были
описаны в отчётах о результатах
трансплантации в пазуху (68, 69). Клетки позитивные к тартрат-резистентной
кислой фосфатазе были определены около поднятой мембраны синуса и близко к
локальному участку кости хозяина (68).
Остеокласты могут происходить из гемопоэтических
клеток-предшественников внутри трансплантата, из кровеносных сосудов, которые
прорастают внутрь аугментированной
области из слизистой
оболочки и местного участка кости хозяина. Необходима дополнительная информация,
чтобы узнать влияют ли на консолидацию трансплантата, на ранние и на поздние
стадии оссеоинтеграции режимы лечения,
воздействующие на системную костную резорбцию.
Так же не ясно, почему аутотрансплантаты иногда полностью рассасываются и не
ремоделируются в кость.
Остеогенные клетки внутри аутотрансплантата способствуют его ранней консолидации
при условии, что питательные вещества и факторы роста диффундируют через сгусток
крови (48, 49). По этой причине должен быть рассмотрен процесс обработки аутотрансплантата.
Ни размалывание, ни разделение на мелкие фрагменты аутотрансплантата
не нарушают жизнеспособности остеогенных клеток (50, 51),
которые выживут в гипоксической
окружающей среде на протяжении, по крайней мере, 3-ёх дней (неопубликованные
наблюдения).
Однако кровеносные сосуды без сомнения необходимы для того,
чтобы обеспечить постоянный источник остеогенных клеток. Происхождение остеогенных
клеток в участках костной регенерации до конца неясно, хотя васкулярные
перициты и клетки, происходящие из крови, являются убедительными кандидатами
на эту роль (47,
49).
Миграция, пролиферация и дифференцировка координируется аутокринными и
паракринными факторами, которые выходят из активированных тромбоцитов (31,
52),
нейтрофилов (53), макрофагов (30), остеогенных
клеток (25) и эндотелиальных клеток
(29), а так же из компонентов внеклеточного матрикса (54).
Костные морфогенетические протеины могут адсорбировать внеклеточные
матричные протеины, такие как
коллаген
I и IV и гепарин, таким образом, увеличение пороговых уровней инициирует
остеогенетическую дифференцировку (55). Основным источником
остеогенных клеток в течение периода
консолидации трансплантата является периост, который имеет мезенхимальные
клетки-предшественники в камбиальном слое и обеспечивает богатый источник
кровеносных сосудов. Слизистая оболочка синуса также содержит остеогенные
клетки, но
то,
что они способствуют консолидации трансплантата является неясным (см.
бокс 2-1) (56).
Остеокластогенез необходим для ремоделирования костного
комплекса трансплантат/губчатая ретикулофиброзная кость. Клетки-предшественники
гемопоэтического
ряда
транспортируются при помощи кровотока. Это означет, что поддержание непрерывного
запаса остеокластов в области трансплантата также требует формирования кровеносных
сосудов.
Остеокластогенез требует микроокружения, обеспечиваемого мезенхимальными
клетками, берущими
начало в остеогенной линии (57). Недавние открытия
наводят на мысль, что остеокласты, так же вовлечены в координацию образования
кости (58).
Хотя
сигналы, которые
контролируют формирование остеокластов известны в деталях (бокс 2-2),
главный сигнал, координирующий костную резорбцию, остаётся неизвестным.
Материалы для трансплантации, мембраны и процесс консолидации
Консолидация зависит от свойств трансплантационного материала
и остеогенного потенциала воспринимающего участка. Для интеграции в воспринимающий
участок трансплант должен давать
возможность кровеносным сосудам врастать в него и давать возможность формироваться
кости на его поверхности. Аутотрансплантаты
обеспечивают источник остеогенных клеток, а так же факторов роста и дифференциации
для поддержки костной регенерации. Кость подвздошного гребня до сих пор считается
золотым стандартом остеогенеза при трансплантации в пазуху. Однако взятие трансплантата
может послужить причиной болезненности и не всегда обеспечивает адекватное
количество кости.
Керамические заменители кости не имеют остеогенной активности и, следовательно,
имеют ограниченные возможности способствовать костной регенерации посредством
остеокондукции (70, 71). В отличие от остеогенеза, остеокондукция включает
в себя аккумуляцию компонентов плазмы, таких как фибронектин и витронектин
на поверхности заменителя кости, который делает возможным прикрепление остеогенных
клеток при помощи рецепторов интегрина и гепаран сульфата (рисунки 2-2 и 2-3)
(72-75).

Рисунок 2-2. Гистологические образцы аугментированных
пазух мини-свиней. В качестве трансплантата использован бычий костный минерал.
Новая
кость, исходящая из костной стенки синуса, непрерывно врастает внутрь аугментированной
области по направлению к мембране синуса. Консолидация достигается приблизительно
через 3-4 месяца. Эта иллюстрация подтверждает, что ксенотрансплантат является
остеокондуктивным, давая возможность вновь образующейся кости "прыгать" с
одной частицы на следующую. Во все временные отрезки в области фронта минерализации
визуализируются большие лакуны остеоцитов, являющиеся характерным признаком
губчатой кости. Эти лакуны врастают приблизительно на 1 мм в неделю внутрь
аугментированной области (Вершины стрелок указывают на верхнюю границу
вновь сформированной кости).
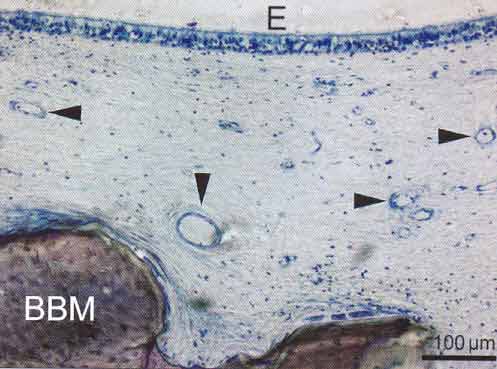
Рисунок 2-3 Мембрана пазухи покрывающая трансплантат
в пазухе. Трансплантат представляет собой бычий костный минерал. Пространство
между эпителием и ксенотрансплантатом содержит кровеносные сосуды (вершины
стрелок) замурованные в рыхлую соединительную ткань собствнной пластинки.
На поверхности частицы ксенотрансплантата не наблюдается формирования кости.
Эта иллюстрация демонстрирует, что для инициализации костеообразования необходимо
наличие микроокружения из живой кости. (BBM - бычий костный минерал, Е - эпителий,
окраска толуидиновым синим).
Использование заменителей кости, покрытых аргинин-глицин-аспартат
кислыми (RGD)-содержащими пептидами является уникальным подходом для содействия
этому процессу. Заменители кости, так же как и аутотрансплантаты, дополнялись
факторами роста, внеклеточным матриксом и остеогенными клетками (77-80),
но являются ли эти лечебные методики существенно более эффективным на сегодняшний
день не ясно (см. главу 30).
Было доложено, что закрытие латерального окна барьерной мембраной улучшает
долговременную выживаемость имплантатов (5). Мембрана
стабилизирует сгусток крови, а так же область трансплантации и служит в
качестве барьера против миграции
неостеогенных клеток из мягких тканей внутрь области дефекта (рисунки 2-4)
(81).
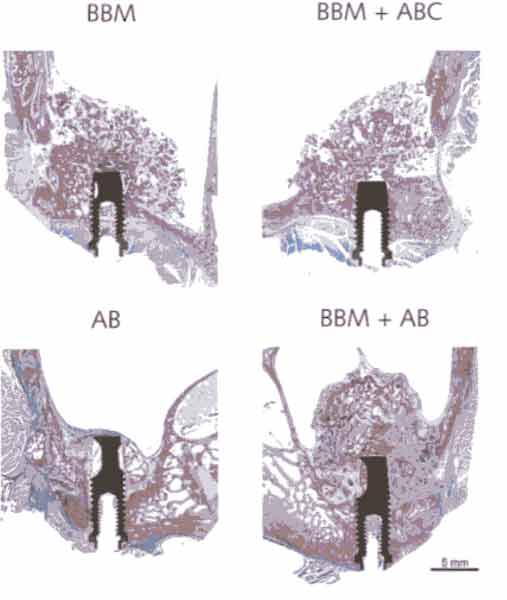
Рисунок 2-4а Эксперимент на мини-свиньях.
Гистологические образцы аугментированных пазух после 12-ти недель заживления.
Имплантаты были
установлены во время проведения аугментации по одностадийной методике. В данной
модели пазухи, в которые вводили аутогенную кость, были сильно резорбированы.
Отметьте, что соединительная ткань, исходящая из костного окна, вторгается
в пространство около области аугментации. (BBM - бычий костный минерал, ABC
-
аутогенные костные
клетки, AB - аутогенная кость. Окраска Levai-Laczko).
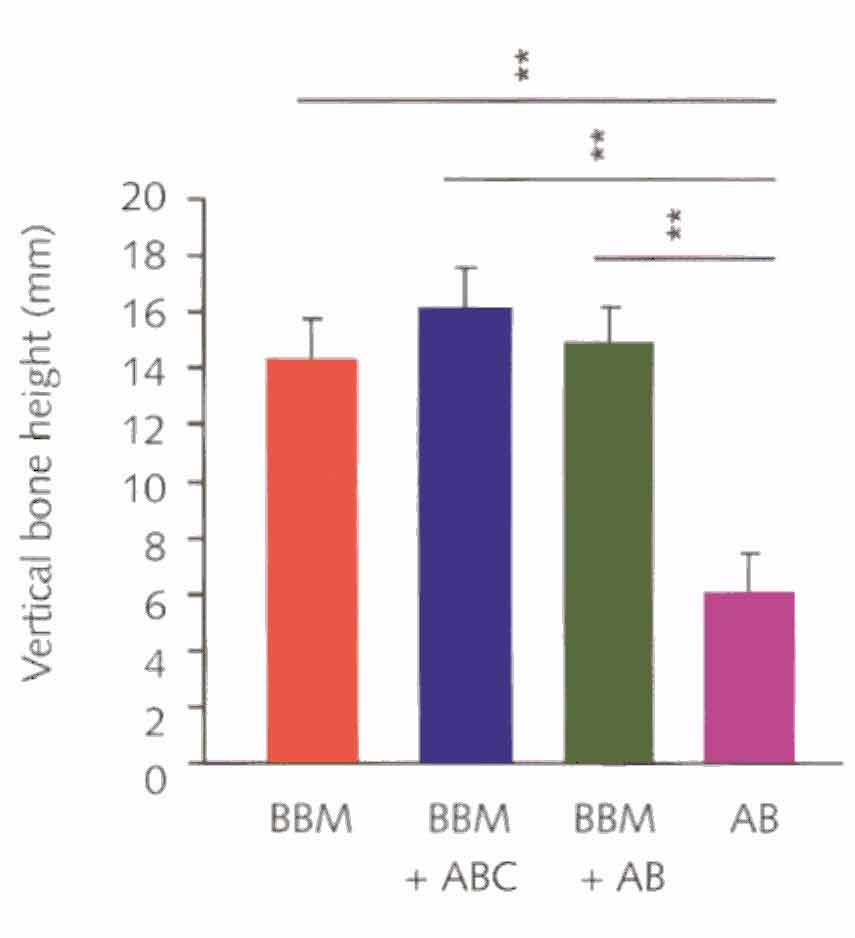
Рисунок 2-4b Гистограмма иллюстрирующая соответственную высоту
области трансплантации. Показатели даны в виде среднеквадратических значений
и соответствующих стандартных отклонений (BBM - бычий костный минерал, ABC
- аутогенные костные
клетки, AB - аутогенная кость, **P <.01.)
Необходимы дальнейшие исследования для того, чтобы определить
какой тип мембраны является предпочтительным и следует ли рекомендовать их
применение
(см. главу 19).
Консолидация трансплантата на фоне болезни
Количество пациентов с возрастными заболеваниями кости, из которых здесь выделен
остеопороз, постоянно возрастало в течение последних десятилетий (82,
83).
Установлено, что в течение жизни риск переломов бедра составляет 17% у белых
женщин и 6% у белых мужчин (82, 84). Транзиторная, но непропорциональная потеря
кости 20-30% в трабекулярной кости и 5-10% в кортикальной кости происходит
у женщин в течение первых десяти лет менопаузы. Следующая постепенная фаза
приводит к утрате 20-30% трабекулярной и кортикальной кости у пожилых индивидуумов
обоих полов (85).
При трансплантации в пазуху сниженное количество минерального матрикса в объёме
кости является важным фактором для рассмотрения. В ретроспективном исследовании
потеря имплантатов после одностадийной процедуры аугментации синуса была выше
у пациентов с низкой минеральной плотностью кости, когда проводили сравнение
с соответствующими по полу и возрасту контрольными группами (86). Эти результаты
наводят на мысль, что остеопороз является возможным фактором риска для выживаемости
имплантатов в аугментированных пазухах. Однако необходимы дальнейшие исследования
для того, чтобы установить взаимосвязь между непропорциональным циклом ремоделирования
при остеопорозе, консолидацией трансплантата и выживаемостью имплантатов. Животные
(овцы, козы, собаки) после овариэктомии могут служить в качестве подходящей
модели для этой цели (87-89).
Кроме того, при остеопорозе должно быть оценено влияние медикаментозных
средств на консолидацию трансплантата и выживаемость имплантатов в аугментированных
пазухах. К таким средствам относятся: препараты гормональной замещающей терапии,
селективные эстрогенные рецепторные модуляторы, гормон околощитовидной железы
и бисфосфонаты
(90).
Например, бисфосфонаты могут увеличить минерализацию кости (91), которая может
способствовать стабильности имплантатов, однако снижение скорости ремоделирования
может иметь негативное влияние на консолидацию трансплантата (см. главу 8).
Возрастная потеря кости связана со снижающимся количеством клеток–предшественников
в костном мозге (92), сниженным хондрогенным потенциалом периоста (93) и ограниченной
способностью к пролиферации и дифференциации остеогенных клеток (94,
95). В
эктопической модели формирование кости, происходящее из костного мозга молодых
животных, было в пять раз выше, чем формирование кости из костного мозга старых
крыс (96). Возраст реципиента имел минимальное влияние, наводя на мысль, что
количество и активность остеогенных клеток внутри костного мозга были ключевым
фактором формирования кости.
Другие эксперименты на животных показывают, что ангиогенез
и васкулогенез снижаются с увеличением возраста (97, 98).
Пролонгированные периоды заживления
и модуляция биоактивных свойств материала при трансплантации могут компенсировать
возрастное ухудшение консолидации трансплантата, как описано в боксе 2-3.
Бокс 2-3 Возможные стратегии для поддержки консолидации трансплантата
Естественные и рекомбинантные факторы роста были тестированы относительно
их потенциала поддержки формирования кости в аугментированных пазухах. Богатая
тромбоцитами плазма (PRP) является аутогенным источником молекул выделяемых
тромбоцитами. Надосадочные жидкости из активированных тромбоцитов являются
в сильной степени митогенными и хемотаксическими для мезенхимальных клеток
предшественников; их остеогенная дифференциация временно подавляется (31) в
присутствии BMPs (99).
Тромбоциты могут индуцировать образование клеток подобных остеокластам in
vitro, и могут способствовать раннему костному ремоделированию (100). Эксперименты
на животных и клинические исследования показали отсутствие или только слабую
стимуляцию регенерации кости и оссеоинтеграции в аугментированных пазухах (101-103).
Возможно, что накопление физиологических количеств тромбоцитов в процессе формирования
кровяного сгустка является достаточным, чтобы индуцировать ступенчатый процесс
заживления у молодых и здоровых пациентов.
У отягощённых пациентов, подвергшихся онкологической резекции,
PRP может усилить процесс костного ремоделирования, поскольку было отмечено
большее количество
пластиночной кости в области трансплантации. В числе рекомбинантных факторов
роста, PDGF был одобрен для лечения хронических язв у пациентов с диабетом
(104) и является потенциальной лечебной опцией при заболеваниях
пародонта (105). Исследований относительно регенерации кости при хирургическом
лечении по поднятию
дна пазухи до сегодняшнего дня не проводилось.
Остеоиндуктивные BMP-2 и BMP-7 были
тестированы для применения при трансплантации в пазуху. Однако носитель имел
ограниченный потенциал с точки зрения обеспечения
пространства (106, 107). При совместном применении с бычьим
костным неорганическим минералом BMP-7 индуцировал гомогенное формирование
кости на всём протяжении
области аугментации в эксперименте на мини-свиньях (108). К
тому же поверхности дентальных имплантатов, в тех случаях, когда их устанавливали
одновременно,
показывали контакт кости и имплантата до 81% (108). Это многообещающий
подход, потому что имплантаты могут перенести функциональную нагрузку в костной
ткани
индуцированной BMP-2 (109).
Ещё одной стратегией для улучшения консолидации трансплантата является добавление
к нему остеогенных клеток аутогенного происхождения (110, 111). Остеогенные
клетки могут быть выделены из периоста, гребня подвздошной кости или костного
мозга, выращены из живых тканей, и помещены в трансплантационный материал (112).
Выращенные (экспандированные) клетки также могут быть смешаны с трансплантационным
материалом непосредственно перед аугментацией синуса (113). Однако, конструкция
трансплантационного материала, остеогенные клетки и минерализованный внеклеточный
матрикс не являются живой костью и требуют ремоделирования, схожего с тем,
который требуется при введении аутогенного трансплантата.
Подходы генной терапии основаны на концепции, по которой трансплантированные
клетки служат в качестве биологических реакторов для производства факторов
роста на протяжении длительного периода времени, действующих через аутокринный
и паракринный механизм (78, 114). Внедрение этой методики привело к обещающим
результатам при регенерации дефектов нижней челюсти (115) и дефектов длинных
трубчатых костей с нарушением их непрерывности в экспериментах на животных.
Не было опубликовано исследований относительно применения
генной терапии для улучшения консолидации трансплантата в пазухе верхней челюсти.
Многие вопросы
остаются открытыми для обсуждения, в частности, какая группа пациентов получит
пользу от усовершенствованной биотехнологии? Какая методика лечения имеет лучшее
соотношение цена/эффективность? Какой подход имеет результатом стойкую консолидацию
трансплантата в долгосрочной перспективе?
Диабет, который также связан с ослабленным ангиогенетическим
потенциалом, может быть причиной неполной оссеоинтеграции дентальных имплантатов
в длинных
костях (117, 118). Однако, пациенты с диабетом, уровни глюкозы
у которых контролируемы, имеют степени успеха схожие по своим показателям с
данными здоровых пациентов
(119, 120). Необходимы исследования для того, чтобы определить
является ли диабет фактором риска для выживаемости имплантатов в аугментированных
областях.
Курение является фактором риска для выживаемости имплантатов в
областях аугментации. Особенно при имплантации в аугментированные
пазухи (121-123). Требуются
дополнительные клинические исследования для того, чтобы идентифицировать пациентов,
у которых
имеется потенциальный
риск неполной
консолидации трансплантата в аугментированном синусе.
Консолидация трансплантата и нагрузка на имплантаты
Имплантаты с шероховатой поверхностью показывают лучшие результаты
при функционировании по сравнению с имплантатами с гладкой поверхностью. Эти
данные получены при
анализе долгосрочных наблюдений (5). Имплантаты с шероховатой
поверхностью способствуют прикреплению формирующегося сгустка крови после установки
имплантата.
Предварительный внеклеточный матрикс сгустка крови дает возможность остеогенным
клеткам мигрировать на поверхность имплантата, где они могут заложить новую
кость, для того чтобы дополнить кость, берущую начало из стенок ложа имплантата
(11). Этим можно объяснить более высокую степень контакта
кость-имплантат на начальных этапах оссеоинтеграции при использовании имплантатов
с шероховатой
поверхностью.
Наличие плотной кости вокруг имплантата является необходимым условием для
адаптации его под нагрузкой. Эта адаптация происходит и в трабекулярной кости,
и в кортикальной кости в форме ремоделирования и моделирования. Данный процесс
основан на восприятии импульсов от механической нагрузки и приводит к клеточной
механической трансдукции.
Превращение механических сил в клеточный ответ включает в себя активацию межклеточных
сигналов индуцируемых растянутыми молекулами цитоскелета и пьезоэлектрическими
потенциалами. Шероховатая поверхность имплантата обеспечивает его плотное соединение
с костью, что инициирует функциональные нагрузки и последующие приспособительные
процессы ремоделирования и моделирования (рисунок 2-5).
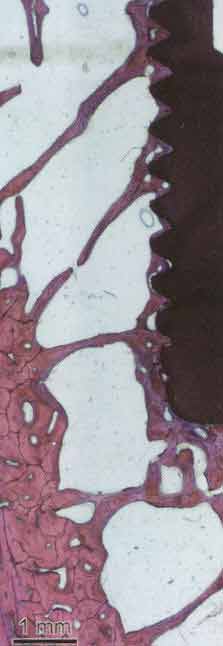
Рисунок 2-5 Имплантат установленный в кость
нижней челюсти нечеловекообразной обезьяны после 18 месяцев функциональной
нагрузки. Костные трабекулы смоделированы так, что функциональная нагрузка
передаётся на окружающую кость. Трабекулярная структура оставляет пространства
для костного мозга, который содержит все необходимые компоненты для костного
ремоделирования, что необходимо для восстановления микротрещин,
образующихся под нагрузкой. Это пример адаптации к силе
жевания периимплантной кости под нагрузкой
.
Кость 4-го типа в дистальном отделе верхней челюсти имеет недостаточный объём
и плотность для противостояния окклюзионной нагрузке. Нормальное усилие жевания
не должно превышать пороговую величину микроповреждений периимплантной кости
приблизительно в 3000 микродеформаций (кость, подвергнутая 3000-ам микродеформаций,
укорачивается на 0.3% от своей начальной длины). Оптимальное перимплантное
костное моделирование происходит при 1000 микродеформаций (124, 125).
Нагрузка на имплантат позитивно влияет на реакцию периимплантной
кости (126),
с одним исключением. В кости типа 4, с недостаточной способностью к выдерживанию
нагрузок, даже оссеоинтегрированные имплантаты с шероховатой поверхностью могут
выйти из строя. Таким образом, цель трансплантации в пазуху увеличить
объём кости и минеральную плотность кости до достаточного уровня, чтобы сделать
возможной взаимосвязь между костью и имплантатом. Эта тесная взаимосвязь распределяет
функциональные силы в рамках физиологических границ.
Ещё раз повторим, что пределы функционального
напряжения, передаваемого дентальными имплантатами на кость, базируются на
адекватной оссеоинтеграции, которая зависит от костного ремоделирования. Последнее
в свою
очередь требует наличия живой костной ткани, которая формируется в результате
консолидации трансплантата.
Потеря большей части костного аутотрансплантата происходит, когда процесс
резорбции кости превалирует над процессом её формирования в период консолидации.
Подобная ситуация увеличивает риск потери имплантата, потому что подверженный
риску костный трансплантат приобретает усталостные характеристики, которые
приводят к неудаче. Для того чтобы преодолеть чрезмерную резорбцию аутотрансплантата
(временами даже полную) и для того, чтобы уменьшить объём кости, которая должна
быть получена при взятии трансплантата, к трансплантату добавляют заменители
кости, которые выбирают из-за их способности медленно резорбироваться.
Эксперименты на животных показывают, что использование заменителей
кости, например таких как минерализованная бычья кость, как в чистом виде,
так и в комбинации с аутотрансплантатом,
сохраняет высоту аугментированного синуса по прошествии долгого времени. В
данной ситуации медленно резорбирующиеся заменители кости выполняют функцию
удержания пространства в процессе консолидации. Кость хозяина, которая окутывает
заменители кости, сохраняет свою способность отвечать на механические нагрузки
через адаптационное ремоделирование и моделирование. При такой стабилизации
наблюдается большая взаимосвязь между костью и имплантатом, и, следовательно,
становится возможным распределение функциональных нагрузок в пределах физиологических
границ, несмотря на добавление, частично неживой примеси.
Мета анализ процедур трансплантации в пазуху показывает, что и по прошествии
долгого времени аутотрансплантаты и заменители кости делают возможным достижение
адекватного уровня выживаемости имплантатов при функциональной нагрузке (5).
Теоретическая концепция управления факторам риска
Часто бывает трудно проанализировать все показатели, касающиеся
общего состояния пациента и эффективности проводимого лечения, прежде чем принять
решение о
продолжительности фазы заживления для консолидации трансплантата. Единая теоретическая
концепция должна начинаться со стандартного 4-ёх месячного периода консолидации
трансплантата. Этот период за тем изменяется с учётом фактора консолидации
трансплантата (GCF – graft consolidation factor), который учитывает такие величины,
как статус здоровья пациента, старение, несовпадающие свойства трансплантационных
материалов, свойства поверхности имплантатов и технические детали хирургической
методики (таблица 2-1).
ТАБЛИЦА 2-1 Факторы консолидации трансплантата (GCFs) и их
теоретическое влияние на время заживления
| Системные болезни и терапия |
Остеопороз (х1.3) |
Диабет (х1.2) |
Химиотерапия (х1.3) |
| Возраст |
<20 (x0.8) |
21-60 (x1.0) |
>61 (x1.2) |
| Остаточная высота кости |
< 6 мм (х1.2) |
6-8 мм (х1.0) |
>8 мм (0.8) |
| Аугментационный материал |
Аутотрансплантат (х1.0) |
Заменитель кости (х1.4) |
Аутотрансплантат+заменитель кости (х1.2) |
| Разрыв слизистой оболочки синуса |
Да (х1.2) |
Нет (х1.0) |
|
| Форма материала |
Блок (х1.2) |
Частицы (х1.0) |
|
| Добавки |
BMP (x0.7) |
PRP (x0.9) |
|
| Факторы образа жизни |
Курение (х1.2) |
Злоупотребление алкоголем (х1.1) |
|
GCF, который базируется на опыте каждого хирурга, за тем умножается
на «стандартное» время периода заживления 4 месяца. При использовании данной
формулы 4 месяца
Х 1.3 (GCF для остеопороза), следует ожидать, что консолидация трансплантата
у пациентов с остеопорозом составит в общей сложности 5.2 месяца.
Если аутотрансплантат используют в комбинации с заменителем
кости, то фаза консолидации трансплантата пролонгируется множителем 1.2 (GCF
для костного
заменителя). В результате время заживления составляет 6.2 месяца. В качестве
альтернативы добавление BMP-2 или BMP-7 к заменителям кости у пациентов с остеопорозом
вероятно будет снижать время заживления до 4.4 месяцев.
Конечно, эти калькуляции базируются на теоретической концепции
и должны быть подтверждены доказанными данными. Более того, высота аугментации,
не говоря
уже о других потенциальных факторах риска, таких как генетический фон и психическое
расстройство, не включены в эти расчёты. Возможные синергетические и антагонистические
эффекты также не рассматриваются в этой упрощённой модели. Однако, при использовании
более совершенной информации возможно провести расчёт приблизительного времени
консолидации трансплантата, по аналогии с расчётом сокращённых периодов заживления
для имплантатов с различными поверхностями, что было подтверждено
клиническими и экспериментальными исследованиями.
Резюме
Хирургический опыт клинициста и контролируемое операционное поле являются,
несомненно, важными для достижения успеха аугментационной процедуры. Так как
многоступенчатый процесс консолидации трансплантата создаёт фундамент для оссеоинтеграции
имплантатов, то возрастает важность понимания биологического процесса консолидации
костного трансплантата. Особенно если мы хотим максимизировать понимание оссеоинтеграции
имплантатов в трансплантате в области дна пазухи.
Консолидация трансплантата является также необходимым условием
для получения периимплантной кости, которая имеет способность адаптации к функциональной
нагрузке, улучшающей минеральную плотность кости на поздних стадиях оссеоинтеграции.
Понимание процесса консолидации трансплантата является трудной задачей из-за
сложного взаимодействия между остеогенными клетками, происходящими из трансплантата
и из тканей хозяина.
Трансплантационные материалы, свойства имплантата, местные и системные сигнальные
молекулы, а также механические силы всё это играет важную роль в данном процессе.
Помимо этого медицинский статус пациента и факторы его образа жизни влияют
на результат лечения и следовательно вносят поправки в сроки заживления при
консолидации трансплантата.
Критерии анамнеза могут помочь нам установить потенциальные факторы риска,
которые могут осложнить консолидацию трансплантата. Эта область исследования
может пролить свет на противоречивые результаты заживления и предоставить доказательства
для определения лучшего подхода при использовании тканевого инжиниринга (рисунок
2-6).
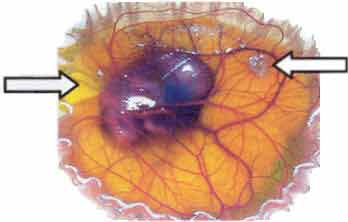
Рисунок 2-6 Хорион-аллантоисная мембрана
(CAM), анализ. Желатиновые губки были погружены в концентрированные надосадочные
жидкости стромальных клеток,
происходящих из костного мозга и помещены наверх CAM (правая стрелка). Губки,
содержащие среду с низким количеством сыворотки, служили контролем (левая
стрелка). Рисунок показывает CAM на 12-й день после оплодотворения. Сосуды
аллантоиса выросли радиально по направлению к губкам, пропитанным концентрированной
надосадочной жидкостью, содержащей стромальные клетки костного мозга, но не
по направлению к губкам, пропитанным средой с низкой концентрацией сыворотки.
Эти данные наводят на мысль, что трансплантированные клетки или внутри аутотрансплантата,
или как дополнение в продуктах тканевого инжиниринга могут поддерживать рост
кровеносных сосудов внутрь аугментированных областей.
Таким образом, необходимые условия для консолидации трансплантата могут быть
индивидуализированы, для того чтобы преодолеть компромиссный биологический
статус (рисунок 2-7).

Рисунок 2-7 Консолидация трансплантата может
быть разделена 3 уровня. Первый уровень, названный клинические параметры, характеризует
показатели статуса
здоровья пациента и факторы его образа жизни, которые могут повлиять на 2-й
уровень – параметры кости. Параметры кости включают остеогенный и ангиогенный
потенциал, а также местную морфологию кости хозяина. Третьим уровнем являются
параметры лечения. Хирурги должны принимать решения относительно типа трансплантационного
материала для использования в конкретной ситуации, решения относительно того
какая процедура трансплантации (одноэтапная или двухэтапная) должна быть использована,
какой хирургический подход выбрать, и возможно ли применение факторов роста
и дифференциации. Все три уровня параметров влияют на консолидацию трансплантата
и, следовательно, на оссеоинтеграцию и при ранних сроках, и при длительных
сроках функционирования имплантатов.
Будущие усилия также должны быть сфокусированы на разработке
процедуры, которая является минимально инвазивной и, помимо этого, делает возможным
предсказуемую
длительную выживаемость дентальных имплантатов в области аугментированного
дна пазухи.
Благодарность
Авторы хотят поблагодарить доктора Jeffrey O. Hollinger (Центр инжиниринга
кости. Университет Карнеги Меллон. Питсбург. Пенсильвания) за критическое чтение
данной рукописи.
Ссылки
1. Cawood JI, HoweII RA. Классификация беззубых челюстей. Int J Oral Maxillofac
Surg 1988;17:232-236.
2. Cawood JI, HoweII RA. Реконструктивная хирургия перед протезированием.
1. Анатомические соображения. Int J Oral Maxillofac Surg 1991;20:75-82.
3. Jensen OT, Shulman LB, Block MS, Iacono VJ. Отчёт о согласительной конференции
по верхнечелюстной пазухе 1996 года. Int J Oral Maxillofac
Implants 1998;13(suppl):11-45.
4. Graziani F, Donos N, Needleman I, Gabriele M, Tonetti M. Сравнение выживаемости
имплантатов, установленных в область аугментации дна синуса и выживаемости
имплантатов, установленных кость верхней челюсти без дополнительных аугментационных
процедур. Систематический обзор. Clin Oral Implants Res 2004;15:677-682.
5. Wallace SS, Froum SJ. Влияние аугментации пазухи верхней челюсти на выживаемость
внутрикостных дентальных имплантатов. Систематический обзор. Ann Periodontol
2003;8:328-343.
6. Esposito M, Hirsch JM, Lekholm U, Thomsen P. Биологические факторы, способствующие
неудачам оссеоинтегрированных оральных имплантатов. 1. Критерии успеха и эпидемиология
Eur J Oral Sci 1998;106: 527-551.
7. BranemarkP-I, Hansson BO, Adell R, et al. Оссеоинтегрируемые имплантаты
при лечении беззубых челюстей. Опыт работы за 10 лет. Scand J Plast Reconstr
Surg Suppl 1977;16:1-132.
8. Schenk RK, Buser D. Оссеоинтеграция: реальность. Periodontol 2000 1998;17:22-35.
9. Berglundh T, Abrahamsson I, Lang NP, Lindhe J. Формирование новой кости
рядом с внутрикостными имплантатами. Clin Oral Implants Res 2003;14:251-262.
10. Botticelli D, Berglundh T, Buser D, Lindhe J. Пересмотренное расстояние
скачка: экспериментальное исследование на собаке. Сlin Oral Implants Res 2003;14:35-42.
11. Davies JE. Понимание заживление вокруг внутрикостных имплантатов. J Dent
Educ 2003;67:932-949.
12. Albrektsson T, Johansson C. Остеоиндукция, остеокондукция и оссеоинтеграция.
Eur Spine J 2001;10(suppl 2):S96-S101.
13. Albrektsson T, Branemark P-I, Hansson HA, Lindstrom J. Оссеоинтегрированные
титановые имплантаты. Требования для обеспечения длительной жёсткой фиксации
имплантатов с непосредственным контактом кость-имплантат у человека. Acta Orthop
Scand 1981;52:155-170.
14. Friberg B, Jemt T, Lekholm U. Ранние неудачи 4641 последовательно установленного
дентального имплантата Branemark: Исследование, начиная с 1-й стадии хирургии
до присоединения окончательных протезов. Int J Oral MaxiIIofac Implants 1991;6:142-146.
15. Lazzara R, Siddiqui AA, Binon P, et al. Ретроспективный мультицентровой
анализ внутрикостных дентальных имплантатов 3i, установленных за период более
5 лет. Clin Oral Implants Res 1996;7:73-83.
16. Lekholm U, Zarb GA. Отбор и подготовка пациента. В книге: Branemark P-I,
Zarb GA, Albrektsson T (редакторы). Протезы, интегрированные в ткани. Оссеоинтеграция
в клинической стоматологии 1985:199-209.
17. Ulm CW, Solar P, Gselmann B, Matejka M, Watzek G. Беззубый альвеолярный
отросток верхней челюсти в области пазухи верхней челюсти. Исследование физических
размеров. Int J Oral Maxillofac Surg 1995;24(4):279-282.
18. Martinez H, Davarpanah M, Missika P, Celletti R, Lazzara R. Оптимальная
стабилизация имплантата в кости низкой плотности. Clin Oral Implants Res 2001;12:423-432.
19. Schenk RK, Hunziker EB. Гистологические и ультраструктурные характеристики
заживления переломов. В книге: Brighton CT, Friedlaender G, Lane JM (редакторы).
Костная регенерация и восстановление. Rosemont, IL: Американская Академия Хирургов-Ортопедов,
1994:117-146.
20. Manolagas SC. Рождение и смерть костных клеток: Основные механизмы регуляции
и участия в патогенезе и лечении остеопороза. Endocr Rev 2000;21:115-137.
21. Chanavaz M. Анатомия и гистофизиология периоста: Количественный анализ
кровоснабжения прилежащей кости с использованием стронция-85 и гамма спектрометрии.
J Oral Implantol 1995;21:214-219.
22. Proussaefs P, Lozada J, Kim J, Rohrer MD. Лечение перфораций мембраны
верхнечелюстной пазухи с использованием резорбируемой коллагеновой мембраны.
Исследование на человеке. Int J Oral Maxillofac Implants 2004;19:413-420.
23. Kandler B, Fischer MB, Watzek G, Gruber R. Выделенная тромбоцитами надосадочная
жидкость увеличивает продукцию матричной металлопротеиназы-2, миграцию, пролиферацию
и формирование трубчатой структуры пупочных сосудистых эндотелиальных клеток
у человека. J Periodontol 2004;75:1255-1261.
24. Sunderkotter C, Steinbrink K, Goebeler M, Bhardwaj R, Sorg C. Макрофаги
и ангиогенез. J Leukoc Biol 1994;55:410-422.
25. Gruber R, Kandler B, Watzek G. Гипоксия не снижает выживаемость BMSC и
не оказывает влияния на ангиогенный потенциал in vitro. Dent J 2005:(in press).
26. Knighton DR, Hunt TK, Scheuenstuhl H, Hlliday BJ, Werb Z, Banda MJ. Давление
кислорода регулирует выделение фактора ангиогенеза макрофагами. Science 1983;221(4617):
1283-1285.
27. Steinbrech DS, Mehrara BJ, Saadeh PB, et al. Выделение VEGF (васкулярный
эндотелиальный фактор роста) в линии остеоподобных клеток регулируется
механизмом отвечающим на гипоксию. Am J Physiol Cell Physiol 2000;278:C853-C860.
28. Sahni A, Francis CW. Васкулярный эндотелиальный фактор роста связывается
с фибриногеном и фибрином и стимулирует пролиферацию эндотелиальных клеток.
Blood 2000;96:3772-3778.
29. Kandler B, Watzek G, Gruber R. Эндотелиальный кондиционированный клеточный
посредник стимулирует миграцию остеогенных клеток. Dent J 2005: (находится
в печати).
30. Singer AJ, Clark RA. Заживление ран кожи. N Engl J Med 1999;341:738-746.
31. Gruber R, Karreth F, Kandler B, et al. Выделенные тромбоцитами надосадочные
жидкости увеличивают миграцию и пролиферацию клеток предшественников происходящих
из костного мозга и снижают их остеогенную дифференциацию в состояниях in vitro.
Platelets 2004;15:29-35.
32. Fiedler J, Roderer G, Gunther KP, Brenner RE. BMP-2, BMP-4, и PDGF-bb
стимулируют хемотаксическую миграцию первичных мезенхимальных клеток-предшественников
человека. J Cell Biochem 2002;87:305-312.
33. Hsieh SC, Graves DT. Импульсное использование фактора роста происходящего
из тромбоцитов усиливает формирование минерализованного матрикса, в то время
как его непрерывное использование ингибирует этот процесс. J Cell Biochem
1998; 69:169-180.
34. Cao R, Brakenhielm E, Pawliuk R, et al. Ангиогенетический синергизм, васкулярная
стабильность и улучшение ишемии задней конечности комбинацией PDGF-BB и FGF-2.
Nat Med 2003;9: 604-613.
35. Richardson TP, Peters MC, Ennett AB, Mooney DJ. Полимерная система для
двойной доставки фактора роста. Nat Biotechnol 2001;19:1029-1034.
36. English D, Welch Z, Kovala AT, et al. Сфингозин -1-фосфат выделенный из
тромбоцитов во время свёртывания объясняет сильную хемотаксическую активность
эндотелиальных клеток сыворотки крови и даёт новое связующее звено между гемостазом
и ангиогенезом. FASEB J 2000;14:2255-2265.
37. Carmeliet P. Механизмы ангиогенеза и артериогенеза. Nat Med 2000;6:389-395.
38. Risau W. Механизмы ангиогенеза. Nature 1997;386 (6626):671-674.
39. Asahara T, Kawamoto A. Эндотелиальные клетки предшественники для постнатального
васкулогенеза. Am J Physiol Cell Physiol 2004;287:C572- C579.
40. Cardaropoli G, Araujo M, Lindhe J. Динамика формирования костной ткани
в лунках после удаления зубов. Экспериментальное исследование на собаках. J
Clin Periodontol 2003;30:809-818.
41. Barnes GL, Kostenuik PJ, Gerstenfeld LC, Einhorn TA. Регуляция факторов
роста при заживлении переломов. J Bone Miner Res 1999;14: 1805-1815.
42. Hu H, Hilton MJ, Tu X, Yu K, Ornitz DM, Long F. Последовательная роль
передачи сигнала Hedgehog и Wnt в эволюции остеобластов. Development 2005;132:49-60.
43. Westendorf JJ, Kahler RA, Schroeder TM. Передача сигнала Wnt в остеобластах
и болезнях кости. Gene 2004;341:19-39.
44. Harada S, Rodan GA. Контроль функции остеобластов и регуляция костной
массы. Nature 2003;423(6937):349-355.
45. Haas R, Donath K, Fodinger M, Watzek G. Бычий гидроксиапатит для трансплантации/имплантации
в пазуху верхней челюсти. Сравнительное гистоморфометрическое исследование
на овцах. Clin Oral Iimplants Res 1998;9:107-116.
46. Taichman RS. Кровь и кость. Две ткани, судьба которых связана с созданием
ниши для гемопоэтических стволовых клеток. Blood 2005;105:2631-2639.
47. Eghbali-Fatourechi GZ, Lamsam J, Fraser D, Nagel D, Riggs BL, Khosla S.
Циркулирующие клетки линии остеобластов у человека. N Engl J Med 2005;12:352:1959-1966.
48. Pittenger MF, Mackay AM, Beck SC, et al. Мультилинейный потенциал зрелых
мезенхимальных стволовых клеток человека. Science 1999; 284(5411):143-147.
49. Doherty MJ, Ashton BA, Walsh S, Beresford JN, Grant ME, Canfield AE. Васкулярные
перициты показывают остеогенный потенциал in vitro и in vivo. J Bone Miner
Res 1998;13:828-838.
50. Gruber R, Baron M, Busenlechner D, Kandler B, Fuerst G, Watzek G. Пролиферация
и остеогенная дифференциация клеток из цилиндров кортикальной кости, костных
частиц из костной мельницы и частичек, полученных при фрезеровании кости.
J Oral Maxillofac Surg 2005;63:238-243.
51. Springer IN, Terheyden H, Geiss S, Harle F, Hedderich J, Acil Y. Измельчённые
костные трансплантаты – эффективность ресурса костных клеток. Clin Oral Implants
Res 2004;15:205-212.
52. Oprea WE, Karp JM, Hosseini MM, Davies JE. Влияние веществ выделенных
из тромбоцитов на миграцию костных клеток и увеличение их численности in vitro.
J Craniofac Surg 2003;14:292-300.
53. Hubner G, Brauchle M, Smola H, Madlener M, Fassler R, Werner S. Дифференциальное
регулирование цитокинов воспаления в процессе заживления раны у нормальных
мышей и мышей, подвергнутых воздействию глюкокортикоидов. Cytokine 1996;8:548-556.
54. Browder T, Folkman J, Pirie-Shepherd S. Свёртывающая система как регулятор
ангиогенеза. J Biol Chem 2000;275:1521- 1524.
55. Paralkar VM, Nandedkar AK, Pointer RH, Kleinman HK, Reddi AH. Взаимодействие
остеогенина, костного морфогенетического протеина связывающего гепарин с коллагеном
4-го типа. J Biol Chem 1990; 265:17281-17284.
56. Gruber R, Kandler B, Fuerst G, Fischer MB, Watzek G. Слизистая оболочка
синуса у свиней содержит в себе клетки, которые реагируют на костный морфогенетический
протеин (BMP)-6 и BMP-7 с увеличенной остеогенетической дифференциацией in
vitro. Clin Oral lmplants Res 2004;15:575-580.
57. Abe E, Yamamoto M, Taguchi Y, et al. Насущная необходимость BMPs-2/4 для
формирования и остеобластов, и остеокластов в культуре костного мозга, полученного
у взрослых мышей: Воображаемый антагонизм. J Bone Miner Res 2000;15:663-673.
58. Martin TJ, Sims NA. Активность остеокластов во взаимосвязанном процессе
формирования и резорбции кости. Trends Mol Med 2005;11:76-81.
59. Teitelbaum SL. Резорбция кости остеокластами. Science 2000; 289(5484):1504-1508.
60. Suda T, Takahashi N, Udagawa N, Jimi E, Gillespie MT, Martin TJ. Модуляция
и дифференцировка остеокластов новыми звеньями рецептора опухолевого некротического
фактора и системами лигандов. Endocr Rev 1999;20:345-357.
61. Eghbali-Fatourechi G, Khosla S, Sanyal A, Boyle WJ, Lacey DL, Riggs BL.
Роль лиганда RANK как посредника при усиленной костной резорбции у женщин на
ранних стадиях менопаузы. J Clin Invest 2003; 111:1221-1230.
62. Teitelbaum SL, Ross FP. Генетическая регуляция развития и функционирования
остеокластов. Nat Rev Genet 2003;4:638-649.
63. Rho J, Takami M, Choi Y. Остеоиммунология: взаимодействие иммунной и костной
систем. Mol Cells 2004;17:1-9.
64. Udagawa N, Kotake S, Kamatani N, Takahashi N, Suda T. Молекулярный механизм
остеокластогенеза при ревматоидном артрите. Arthritis Res 2002;4:281-289.
65. Ito H, Koefoed M, Tiyapatanaputi P, et al. Ремоделирование кортикальной
кости аллотрансплантатов при посредничестве адэрентной генной терапии rAAV-RANKL
и VEGF. Nat Med 2005;11:291-297.
66. Kon T, Cho TJ, Aizawa T, et al. Выделение остеопротегерина, активатора
рецептора NF-kappaB лиганда (остеопротегерин лиганд) и родственных провоспалительных
цитокинов в процессе заживления перелома. J Bone Miner Res 2001;16:1004-1014.
67. Trisi P, Rebaudi A. Постепенная адаптация кости к титановым имплантатам
в процессе и после ортодонтической нагрузки у человека. Int J Periodontics
Restorative Dent 2002;22:31-43.
68. Xu H, Shimizu Y, Asai S, Ooya K. Трансплантация депротеинизированных костных
частиц ингибирует резорбцию кости после поднятия дна пазухи верхней челюсти.
Clin Oral Implants Res 2004;15:126-133.
69. Tadjoedin ES, de Lange GL, Bronckers AL, Lyaruu DM, Burger EH. Депротеинизированная
губчатая бычья кость (Bio-Oss) в качестве костного заменителя при поднятии
дна синуса. Ретроспективное гистоморфометрическое исследование пяти случаев.
J Clin Periodontol 2003;30:261-270.
70. Bucholz RW. Остеокондуктивные заменители кости неаллогенного происхождения
для трансплантации. Clin Orthop 2002;395:44-52.
71. Bauer TW, Muschler GF. Материалы для костной трансплантации. Обзор фундаментальной
науки. Clin Orthop 2000;371:10-27.
72. McFarland CD, Mayer S, Scotchford C, Dalton BA, Steele JG, Downes S. Прикрепление
культивированных костных клеток человека к новым полимерам. J Biomed Mater
Res 1999;44:1-11.
73. Kilpadi KL, Chang PL, Bellis SL. Гидроксиапатит связывает больше сывороточных
протеинов, очищенных интегринов и клеток предшественников остеобластов,
чем титан или сталь. J Biomed Mater Res 2001;57:258-267.
74. Kilpadi KL, Sawyer AA, Prince CW, Chang PL, Bellis SL. Первичные стволовые
клетки костного мозга человека и клетки остеосаркомы Saos-2 используют разные
механизмы прикрепления к гидроксиапатиту. J Biomed Mater Res A 2004;68:273-285.
75. Clark RA, Lin F, Greiling D, An J, Couchman JR. Насильственная миграция
фибробластов внутрь фибронектин/фибрин гелей требует не описанного ранее дерматантного
протеогликана сульфат-CD44. J Invest Dermatol 2004;122:266-277.
76. Degidi M, Piattelli M, Scarano A, Iezzi G, Piattelli A. Аугментация пазухи
верхней челюсти с использованием синтетического пептида связывающего клетки.
Гистологические и гистоморфометрические результаты у человека. J Oral Implantol
2004;30:376-383.
77. Meyer U, Joos U, Wiesmann HP. Биологические и биофизические принципы в
экстракорпоральном инжиниринге костной ткани. Часть 1. Int J Oral Maxillofac
Surg 2004;33:325-332.
78. Wiesmann HP, Joos U, Meyer U. Биологические и биофизические принципы в
экстракорпоральном инжиниринге костной ткани. Часть 2. Int J Oral Maxillofac
Surg 2004;33:523-530.
79. Meyer U, Joos U, Wiesmann HP. Биологические и биофизические принципы в
экстракорпоральном инжиниринге костной ткани. Часть 3. Int J Oral Maxillofac
Surg 2004;33:635-641.
80. Jadlowiec JA, Celil AB, Hollinger JO. Инжиниринг костной ткани: Недавние
достижения и многообещающие терапевтические факторы. Expert Opin Biol Ther
2003;3:409-423.
81. Hammerle CH, Jung RE. Костная аугментация с использованием барьерных мембран.
Periodontol 2000 2003;33:36-53.
82. Cummings SR, Melton LJ. Эпидемиология и последствия переломов при остеопорозе.
Lancet 2002;359(9319):1761-1767.
83. Clark S. Остеопороз – болезнь 21-го века? Lancet 2002;359(9319):1714.
84. Melton U III. Кто болен остеопорозом? Противоречие между видом на будущее
с клинической точки зрения и точки зрения общественного здоровья. J Bone
Miner Res 2000;15:2309-2314.
85. Riggs BL, Melton U III. Инволюционный остеопороз. N Engl J Med 1986;314:1676-1686.
86. Blomqvist JE, Alberius P, Isaksson S, Linde A, Obrant K. Значение качества
костного трансплантата для интеграции имплантата после реконструкции пазухи
верхней челюсти. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;86:268-274.
87. Newton BI, Cooper RC, Gilbert JA, Johnson RB, Zardiackas LD. Овца после
овариэктомии как модель для изучения утраты кости человеком. J Comp Pathol
2004;130:323-326.
88. Leung KS, Siu WS, Cheung NM, et al. Козлы как модель для изучения остеопении
у животных. J Bone Miner Res 2001;16:2348-2355.
89. Frenkel SR, Jaffe WL, Valle CD, et al. Влияние алендроната (Fosamax)
и поверхности имплантата на костную интеграцию и ремоделирование в эксперименте
на собаке. J Biomed Mater Res 2001;58:645-650.
90. Delmas PD. Лечение остеопороза после менопаузы. Lancet 2002;359(9322):2018-2026.
91. Roschger P, Rinnerthaler S, Yates J, Rodan GA, Fratzl P, Klaushofer K.
Алендронат увеличивает степень и однородность минерализации губчатой кости
и понижает пористость кортикальной кости у женщин с остеопорозом. Bone 2001;29:
185-191.
92. D'Ippolito G, Schiller PC, Ricordi C, Roos BA, Howard GA. Связанный с
возрастом остеогенный потенциал мезенхимальных стромальных стволовых клеток
из костного мозга позвоночника человека. J Bone Miner Res 1999;14:1115-1122.
93. O'Driscoll SW, Saris DB, Ito Y, Fitzimmons JS. Хондрогенный потенциал
периоста снижается с возрастом. J Orthop Res 2001;19:95-103.
94. Bellows CG, Pei W, Jia Y, Heersche JN. Пролиферация, дифференциация и
самообновление костных предшественников в клеточных популяциях позвоночника
у старых и молодых самок крыс. Mech Ageing Dev 2003;124:747-757.
95. PfeilschifterJ, Diel I, Pilz U, Brunotte K, Naumann A, Ziegler R. Митогенная
реактивность костных клеток человека in vitro к гормонам и факторам роста снижается
с возрастом. J Bone Miner Res 1993;8:707-717.
96. Inoue K, Ohgushi H, Yoshikawa T, et al. Влияние старения на формирование
кости в пористом гидроксиапатите. Биохимический и гистологический анализ.
J Bone Miner Res 1997;12:989-994.
97. Shimada T, Takeshita Y, Murohara T, et al. Ангиогенез и васкулогенез ослаблен
у преждевременно состарившихся мышей klotho. Circulation 2004;110:1148-1155.
98.
Rivard A, Fabre JE, Silver M, Chen D, et al. Ухудшение ангиогенеза с возрастом.
Circulation 1999;99:111-120.
99. Gruber R, Kandler B, Fischer MB, Watzek G. Остеогенная дифференциация,
индуцированная костным морфогенетическим протеином in vitro, может быть подавлена
надосадочной жидкостью выделенной тромбоцитами. Clin Oral Implants Res (на
исправлении) 2005.
100. Gruber R, Karreth F, Fischer MB, Watzek G. Надосадочные жидкости выделяемые
тромбоцитами стимулируют образование остеокластоподобных клеток через простогландин/RANKL-зависимый
механизм. Bone 2002;30:726-732.
101. Jakse N, Tangl S, Gilli R, et al. Влияние PRP на аутогенный трансплантат
в верхнечелюстной пазухе. Экспериментальное исследование на овцах. Clin Oral
Implants Res 2003;14:578-583.
102. Fuerst G, Gruber R, Tangl S, et al. Трансплантация в пазуху верхней челюсти
с использованием аутогенной богатой тромбоцитами плазмы и бычьего гидроксиапатита.
Гистоморфометрическое исследование на мини-свиньях. Clin Oral Implants Res
2003;14:500-508.
103. Wiltfang J, Schlegel KA, Schultze-Mosgau S, Nkenke E, Zimmermann R, Kessler
P. Аугментация дна пазухи верхней челюсти с использованием бета-три-фосфата
кальция (beta- TCP). Способствует ли плазма богатая тромбоцитами его оссеоинтеграции
и деградации? Clin Oral Implants Res 2003;14:213-218.
104. Perry BH, Sampson AR, Schwab BH, Karim MR, Smiell JM. Мета-аналитический
подход к комплексному заключению об эффективности. Детальное исследование бикаплемированного
геля. Control Clin Trials 2002;23:389-408.
105. Nevins M, Camelo M, Nevins ML, Schenk RK, Lynch SE. Пародонтальная регенерация
у человека при использовании рекомбинантного человеческого фактора роста-BB
тромбоцитарного происхождения (rhPDGF-BB) и аллогенной кости. J Periodontol2003;74:1282-1292.
106. Boyne PJ, Marx RE, Nevins M, et al. Анализ экономической целесообразности
оценки абсорбируемой коллагеновой губки на основе rhBMP-2 для аугментации в
области дна верхнечелюстной пазухи. Int J Periodontics Restorative Dent 1997;17:11-25.
107. van den Bergh JP, ten Bruggenkate CM, Groeneveld HH, Burger EH, Tuinzing
DB. Рекомбинантный человеческий костный морфогенетический протеин-7 при
хирургическом поднятии дна пазухи верхней челюсти у 3-х пациентов в сравнении
с аутогенными
костными трансплантатами. Клиническое исследование (первое из серии). J
Clin Periodontol 2000;27:627-636.
108. Terheyden H, Jepsen S, Moller B, Tucker MM, Rueger DC. Аугментация дна
пазухи с одновременной установкой дентальных имплантатов при использовании
комбинации депротеинизированного костного ксенотрансплантата и рекомбинантного
человеческого остеогенного протеина-1. Гистометрическое исследование на мини-свиньях.
Clin Oral Implants Res 1999;10:510-521.
109. Jovanovic SA, Hunt DR, Bernard GW, et al. Долговременная функциональная
нагрузка дентальных имплантатов в кости индуцированной rhBMP-2. Гистологическое
исследование на модели аугментированного гребня собаки. Clin Oral Implants
Res 2003;14:793-803.
110. Cancedda R, Dozin B, Giannoni P, Quarto R. Тканевой
инжиниринг и клеточная терапия хряща и кости. Matrix Biol 2003;22:81-91.
111. Caplan AI , Bruder SP. Мезенхимальные стволовые клетки - строительные
блоки для молекулярной медицины в 21-м веке. Trends Mol Med 2001;7:259-264.
112. Schmelzeisen R, Schimming R, Sittinger M. Создание кости. Установка
имплантатов в кость, полученную путём тканевого инжиниринга для аугментации
дна пазухи
верхней челюсти. Предварительный отчёт. J Craniomaxillofac Surg 2003;31:34-39.
113. Fuerst G, Tangl S, Gruber R, Gahleitner A, Sanroman F, Watzek G. Образование
кости после трансплантации в пазуху материала с аутогенными костными клетками
и бычьего костного минерала у мини-свиней. Предварительные данные. Clin Oral
Implants Res 2004;15:733-740.
114. Dai J, Rabie AB, Hagg U, Xu R. Стратегии альтернативной генной терапии
для восстановления кранио-фациальных костных дефектов. Curr Gene Ther 2004;4:469-485.
115. Park J, Ries J, Gelse K, Kloss F, von der Mark K, Wiltfang J, et al.
Регенерация кости в дефектах критического размера с участием BMP-2 генного
трансфера, являющегося клеточным посредником. Сопоставление аденовирусных векторов
и липосом. Gene Ther 2003;10:1089-1098.
116. Lieberman JR, Daluiski A, Stevenson S, et al. Эффект региональной генной
терапии с применением костного морфогенетического протеина-2, продуцирующего
клетки костного мозга при восстановлении сегментных дефектов бедренной кости
у крыс. J Bone Joint Surg Am 1999;81:905-917.
117. Nevins ML, Karimbux NY, Weber HP, Giannobile WV, Fiorellini JP. Заживление
раны вокруг внутрикостных имплантатов при экспериментальном диабете. Int J
Oral Maxillofac Implants 1998;13:620-629.
118. Siqueira JT, Cavalher-Machado SC, Arana-Chavez VE, Sannomiya P. Формирование
кости вокруг титановых имплантатов в большой берцовой кости у крыс. Роль инсулина.
Implant Dent 2003;12:242-251.
119. Farzad P, Andersson L, Nyberg J. Лечение с применением дентальных имплантатов
у пациентов с диабетом. Implant Dent 2002;11:262-267 .
120. Abdulwassie H, Dhanrajani PJ. Диабет mellitus и дентальные имплантаты.
Клиническое исследование. Implant Dent 2002;11:83-86.
121. Woo VV, Chuang SK, Daher S, Muftu A, Dodson TB. Процедуры дентоальвеолярной
реконструкции как фактор риска при имплантации. J Oral Maxillofac Surg 2004;62:773-780.
122. Kan JY, Rungcharassaeng K, Lozada JL, Goodacre CJ. Влияние курения на
успех имплантции при трансплантации в пазуху верхней челюсти. J Prosthet
Dent 1999;82:307-311.
123. Widmark G, Andersson B, Carlsson GE, Lindvall AM, Ivanoff CJ.Реабилитация
пациентов с большой резорбцией верхней челюсти с применением имплантатов
в сочетании с костной трансплантацией или без неё. Клинический отчёт о диспансерном
наблюдении от 3-х до 5-ти лет. Int J Oral Maxillofac Implants 2001;16:73-79.
124. Frost HM. Закон Вольфа и структурные адаптационные реакции кости к механической
нагрузке. Обзор для клиницистов. Angl Orthod 1994;64(3):175-188.
125. Frost HM. Новые данные за 2003 год о физиологии кости и законе Вольфа
для клиницистов. Angle Orthod 2004;74:3-15.
126. Gotfredsen K, Berglundh T, Lindhe J. Реакции кости около титановых имплантатов
с различными характеристиками поверхности в условиях статической нагрузки.
Исследование на собаках. 2. Clin Oral Implants Res 2001;12:196-201.







